Titration: Aufbau und Durchführung

Mithilfe der Titration kann die unbekannte Konzentration einer Stoffmenge bestimmt werden, indem ein anderer Stoff darin titriert wird. Für dieses Verfahren kommen verschiedene Methoden in Betracht. Welche Reaktionstypen möglich sind, worauf beim Titrations-Aufbau zu achten ist und wie der Endpunkt richtig bestimmt wird, erklären wir hier für Sie.
Titration Definition – Was ist das?
Bei einer Titration handelt es sich um ein experimentelles Verfahren, bei der die Konzentration eines Stoffes bestimmt werden kann. Das kann aus unterschiedlichen Gründen sinnvoll sein – beispielsweise ist die molare Konzentration von Säuren und Basen nicht immer auf der Verpackung angegeben. Darüber hinaus nutzen verschiedene Industrien die Titration für beispielsweise:
- die Herstellung von Medikamenten
- Herstellung von Lebensmitteln
- die Überwachung von Wasser, Boden und Umwelt
Für die klassische Säure-Basen-Titration wird eine Maßlösung bzw. Reagenzlösung verwendet, bei der die Stoffkonzentration bekannt ist. Diese wird so lange in die Probelösung mit der unbekannten Konzentration und einem Farbindikator getröpfelt, bis es zu einem Farbumschlag kommt. Dieser Punkt wird als Äquivalenzpunkt bezeichnet: Die Stoffkonzentrationen von Säure und Base sind dort gleich. Anhand des Verbrauchs der Maßlösung lässt sich berechnen, welche Konzentration des Stoffes in der Probelösung vorliegt.
Je nachdem, um was für ein Säure-Basen-Paar es sich handelt, kann der Äquivalenzpunkt an verschiedenen Stellen liegen. Bei der Kombination von starker Säure und starker Base entspricht er beispielsweise dem Neutralpunkt, sodass der Indikator einen Farbumschlag bei einem pH-Wert von 7 ermöglichen muss.
Titrations-Methoden
Für das Analyseverfahren der Titration kommen mehrere Methoden infrage, die sich hinsichtlich der Durchführungsweise und auch bezüglich des Aufbaus voneinander unterscheiden. Prinzipiell kann dabei zwischen direkter, indirekter und eine automatischer Titration differenziert werden.
Direkte Titration
Von einer direkten Titration ist die Rede, wenn bei dem Verfahren die Maßlösung und die Probelösung direkt miteinander umgesetzt werden. Das bedeutet, dass entweder die Probelösung direkt in die Maßlösung getröpfelt wird oder eine vorher abgemessene Menge der Maßlösung mit der Probelösung titriert wird. Im zweiten Fall wird auch von einer inversen Titration gesprochen.
Indirekte Titration
Bei der indirekten Titration wird ein Zwischenschritt eingefügt, da die Maßlösung zuerst in einer chemischen Reaktion umgesetzt werden muss. Bei der folgenden Titration lassen sich wiederum drei Methoden unterscheiden:
- Indirekte Titration im engeren Sinne: Beim indirekten Titrieren wird die Probelösung in einer chemischen Reaktion umgesetzt, wobei der entstehende Stoff vorher genau festgelegt wurde. Dieser wird im Anschluss mithilfe der Titration bestimmt.
- Rücktitration: Die Rücktitration basiert hingegen auf dem Prinzip, dass zuerst die gesamte Probelösung vollständig mit einer Maßlösung umgesetzt wird, wobei diese über ein bekanntes Volumen verfügt. Der verbleibende, unverbrauchte Teil der Reagenzlösung kann in der Folge titriert und bestimmt werden.
- Substitutionstitration: Hierbei setzt der zu bestimmende Stoff zuerst einen anderen Stoff frei (er „substituiert“ ihn folglich), der wiederum rücktitriert werden kann.
Automatische Titration
Dritter im Bunde ist die automatische Titration. Beim automatischen Titrieren wird der pH-Wert der Lösung mit einem PC bestimmt, sodass die Titrationsflüssigkeit ganz automatisch eingetröpfelt wird. Dadurch können beispielsweise menschliche Fehler ausgeschlossen werden. Das System übernimmt nicht nur die Auswertung, sondern ermöglicht auch eine direkte Weiterverarbeitung der Messergebnisse. Dadurch lässt sich auch der Konzentrationswert ohne Zwischenschritt errechnen.
Prinzip des Titrations-Aufbau
Obwohl es diverse Methoden und Reaktionstypen gibt, lässt sich das Prinzip des Titrations-Aufbaus am besten an der klassischen Säure-Base-Titration erläutern. Am einfachsten lässt sich dies am Beispiel von Salzsäure (HCl) und Natronlaube (NaOH) als starkes Säure-Basen-Paar nachvollziehen. Dabei wird von mehreren Grundprinzipien ausgegangen:
- Abmessung und Volumendefinition: Um die unbekannte Stoffkonzentration herauszufinden, muss der Titrant in einem definierten Volumen an Lösungsmittel (zumeist Wasser) gelöst werden. Das können beispielsweise 100 ml HCl mit unbekannter Konzentration sein. Hinzu kommt ein Indikator, der einen Farbumschlag bei einem neutralen pH-Wert erzeugt.
- Zugabe der Maßlösung: Unter Rühren und/oder Schütteln wird in einem nächsten Schritt eine Maßlösung in die Probelösung getröpfelt. Diese enthält den Titrator mit bekannter Konzentration, etwa NaOH mit 0,1 mol/l.
- Erreichen des Äquivalenzpunktes: Die beiden Lösungen reagieren nun miteinander, wobei in diesem Fall folgende Gleichung gilt:
| NaOH + HCl ? NaCl + H2O |
Mithilfe der Bürette wird die Maßlösung so lange in die Probelösung getröpfelt, bis der Äquivalenzpunkt erreicht ist. Dieser Punkt gleicht bei starken Säuren und Basen dem Neutralpunkt, sodass dort ein pH von 7 herrscht. Dieser wird durch den Farbumschlag des Indikators optisch angezeigt. In der Lösung befindet sich nun genau die gleiche Stoffmenge an Salzsäure und an Natronlauge, also
| n(NaOH) = n(HCl) |
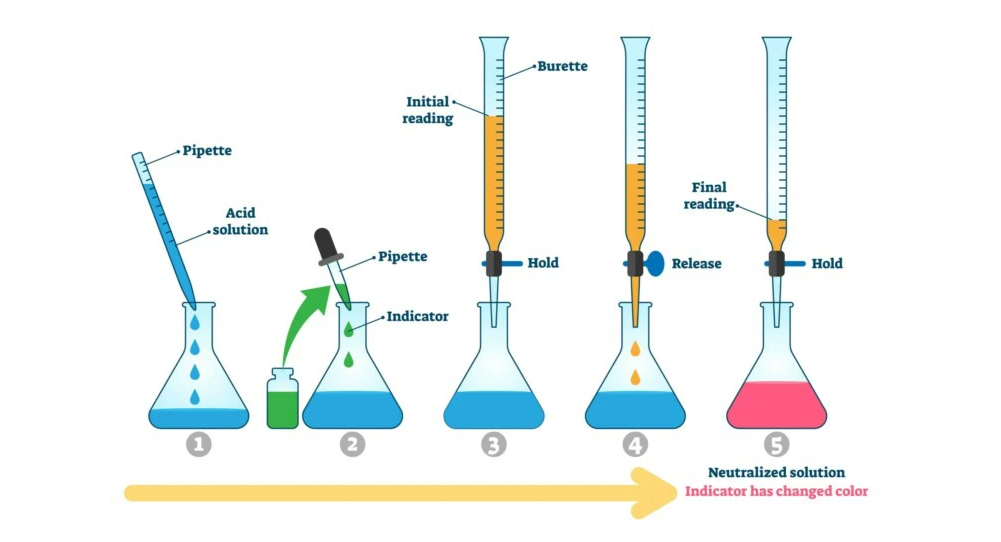
Titration: Aufbau des Versuchs
Damit ein exaktes Messergebnis erzeugt werden kann, sollte beim Versuchsaufbau auf einige Dinge geachtet werden. Dazu gehören neben genauen Abmessungen auch das richtige Equipment und die optimale Vorgehensweise.
1. Titration: Geräte für das Verfahren
Um eine Säure-Basen-Titration durchzuführen, werden für den Titrations-Versuchsaufbau üblicherweise erst einmal die folgenden Geräte benötigt:
- Bürette
- Becherglas
- Stativ
- pH-Sensor oder Indikator
- Magnetrührer und Rührfisch
2. Chemikalien/Titrierlösung
Hinzu kommen unterschiedliche Stoffe. Bei einer Säure-Base-Titration werden verwendet:
- entweder eine starke Säure und eine starke Base
- oder eine Kombination aus starker Säure und konjugierter Base konjugierter Säure und starker Base.
Üblich ist allerdings die Kombination von Salzsäure und Natronlauge, wobei einer der Stoffe über eine bekannte Konzentration verfügt – das muss beim Dosieren der Fluide berücksichtigt werden. In unserem Beispiel wird davon ausgegangen, dass die Konzentration der Natronlauge bei 0,1 mol/l liegt und jene der Salzsäure unbekannt ist.
Oftmals wird außerdem ein Indikator hinzugegeben, der das Erreichen des Äquivalenzpunktes mithilfe eines Farbumschlags anzeigt. Je nach Endpunktbestimmung können aber auch andere Verfahren eingesetzt werden.
3. Titration: Geräte aufbauen
In einem ersten Schritt wird die Bürette am Stativ befestigt, sodass sie sich über dem Becherglas mit der unbekannten Stoffmenge an Salzsäure befindet. Dieses steht wiederum auf dem Magnetrührer. In die Bürette wird die bekannte Stoffmenge Natronlauge eingefüllt. Wichtig ist, hierbei absolut blasenfrei zu arbeiten, damit die verbrauchte Menge später exakt abgelesen werden kann.
4. Rührfisch einlegen
Danach kann bereits der Rührfisch in das Becherglas gelegt werden. Durch das Einschalten des Magnetrührers beginnt er, langsam zu rühren. Dadurch kann sichergestellt werden, dass die beiden Stoffe im Titrations-Versuchsaufbau optimal miteinander vermischt werden – so können Messfehler ganz einfach vermieden werden.
5. Elektrode eintauchen
Im Anschluss kann ebenfalls die pH-Elektrode eingetaucht werden. Diese wird mit einem PC verbunden und bestimmt laufend den pH-Wert. Wird der Äquivalenzpunkt bei einem pH von 7 erreicht, lässt sich der Versuch so direkt an der richtigen Stelle beenden.
Alternativ kann auch ein Indikator verwendet werden. Dieser sorgt beim Erreichen des Äquivalenzpunktes für einen Farbumschlag, was ebenfalls auf einen neutralen pH-Wert hindeutet. Folglich muss eine Indikatorlösung gewählt werden, deren Farbumschlag genau an der richtigen Stelle liegt.
6. Messung starten
Die Messung wird gestartet, indem die Maßlösung mit der Bürette langsam in das Becherglas mit der Probelösung getropft wird. Bei einem pH von 7 muss die Messung gestoppt werden, um eine erfolgreiche Titration durchzuführen und die Stoffkonzentration der Salzsäure bestimmen zu können. Dort befindet sich der Neutralpunkt, an denen die beiden Stoffe im Becherglas die gleiche Konzentration aufweisen.
7. Titration Auswertung
Wie unter dem Punkt „Prinzipen des Titrations-Aufbaus“ kurz erklärt, gilt für unser Beispiel die Neutralisationsgleichung:
| NaOH + HCl ? NaCl + H2O |
Das verbrauchte Volumen von NaOH (mit einer Stoffkonzentration von 0,1 mol/l) bis zum Äquivalenzpunkt ist durch das langsame Tröpfeln ebenfalls bekannt. Dieses kann durch eine Titrations-Skizze nachverfolgt werden.
So lässt sich die Titration berechnen: Liegt der Äquivalenzpunkt beispielsweise bei 0,05 l (auf 100 ml Salzsäure), können die Werte entsprechend in die Titrationsformel eingesetzt werden.
Es gilt:
| n(HCl)/n(NaOH) =1 |
Schlussfolgerung:
| n(NaOH)=c(NaOH)*V(NaOH)=0,1 mol/L*0,05 L=0,005 mol=n(HCl) |
Es ergibt sich 0,005mol/0,1L=0,05 mol/L als Konzentration der Salzsäure.
Reaktionstypen im Titrations-Aufbau
Die Art der Reaktion zum Bestimmen der Konzentration eines bestimmten Stoffes ist nicht immer gleich – je nach Stoffart und Indikator kommen mehrere Reaktionstypen infrage. Diese werden nach chemischer Reaktion unterschieden. Besonders bekannt ist etwa die Säure-Base-Titration, aber auch andere Varianten kommen infrage.
Säure-Basen-Titration
Die Säure-Base-Titration wird verwendet, um die Stoffkonzentration einer Säure oder Base mit dem Gegenstück zu bestimmen. Dafür wird üblicherweise ein Indikator verwendet, der beim Erreichen des pH-Werts von 7 farblich umschlägt. Prinzipiell lässt sich dieser Reaktionstyp in zwei Untergruppen differenzieren
- Alkalimetrie: Bei der Alkalimetrie wird die Säurenmenge berechnet, indem eine bekannte Stoffmenge der Base zur unbekannten Stoffmenge der Säure gegeben wird.
- Acidimetrie: Andersherum läuft es bei der Acidimetrie bzw. Azidimetrie ab. Hierbei wird eine Basenmenge berechnet, indem eine bekannte Säurenmenge zu einer unbekannten Basenmenge gegeben wird.
Fällungstitration
Bei einer Fällungstitration wird nicht mit einer Änderung des pH-Wertes, sondern mit einer Fällungsreaktion beim Erreichen des Äquivalenzpunktes gearbeitet. Dieser wird durch einen Niederschlag in der Lösung sichtbar, der von den verwendeten Stoffen abhängt. Zu den üblichen Fällungsreaktionen gehört etwa die Verwendung von Silberionen und Chloridionen nach Gay Lussac und Liebig: Diese führt zu einem milchig weißen Niederschlag.
In einigen Fällen wird die Reaktion durch die Zugabe von Farbstoffen unterstützt, um den Niederschlag visuell besser erkennbar zu machen. Bei der Titration nach Fajans werden beispielsweise Eosin oder Fluorescein verwendet. Bei der Titration nach Volhard entsteht hingegen farbiges Eisenrhodanit (heute sagt man eher Eisenthiocyanat) und nach Mohr Silberchromat.
Redoxtitration
Ist von einer Redoxtitration die Rede, kommt es zu einer vollständigen Umsetzung der Probelösung durch die Maßlösung. Dabei wird der Gehalt an Stoffen in der Lösung bestimmt, die sich oxidieren oder reduzieren lassen. Zumeist wird ein Eigenindikator verwendet, der den Reaktionsendpunkt anzeigt – also den Zeitpunkt, an dem die Probelösung vollständig reduziert oder oxidiert ist.
Bekannte Verfahren der Redoxtitration sind vor allem die Manganometrie, die Iodatometrie, die Bromatometrie und die Cerimetrie. Sie sind jeweils nach der verwendeten Maßlösung benannt.
Komplexometrische Titration
Bei der komplexometrischen Titration kommt es zu einer Komplexbildungsreaktion, weshalb auch hier der Name wieder Programm ist. Dieser Reaktionstyp wird eingesetzt, um den Gehalt von Metall-Ionen in einer Lösung zu bestimmen. Die Komplexe binden sich an die Metall-Ionen, wodurch sich die Lösung verfärbt. Alternativ kann das Ende der Reaktion auch photometrisch bestimmt werden.
Manchmal ist allerdings schwierig zu erkennen, an welches Metall-Ion sich die Komplexe in der Lösung tatsächlich binden. Daher gilt dieses Verfahren als wenig selektiv, weshalb es sich nicht für jeden Verwendungszweck eignet.
Polyelektrolyttitration
Noch spezifischer wird es bei der Polyelektrolyttitration. Dabei wird der kationische Bedarf an Polyelektrolyten bestimmt, was der Ladungsintensität entspricht. Als Titranten werden bei diesem Reaktionstypen primär PolyDADMAC (bei einer anionischen Suspension) oder Kaliumpolyvinylsulfat (bei einer kationischen Suspension) eingesetzt.
Phasentransfer
Zusätzlich kann der sogenannte Phasentransfer erwähnt werden. Er dient zur Bestimmung von ionischen Tensiden, die in einer wässrigen Lösung vorliegen. Als Endpunkt wird auch bei dieser Methode ein Farbumschlag verwendet – und zwar jener der Stoffmischung in der organisch-chlorierten Phase.
Endpunktbestimmung im Titrations-Aufbau
Aprops Endpunkt: Nicht nur die Reaktionstypen können sich unterscheiden, sondern auch die Verfahren zur Bestimmung des Endpunktes. Bei der Titrations-Durchführung lassen sich prinzipiell chemische und physikalische Indikatoren unterscheiden. So lässt die Indikatorlösung eine visuelle (chemische) Endpunkterkennung zu, während sowohl die Potentiometrie als auch die Konduktometrie instrumentell (physikalisch) ablaufen.
Indikatorlösung
Zu den häufigsten Verfahren zählt die Zugabe einer Indikatorlösung. Diese reagiert auf den pH-Wert in der Lösung und schlägt an einem bestimmten Punkt in eine andere Farbe um. Bei einer Säure-Base-Titration befindet sich der Endpunkt beim pH-Wert von 7, sodass hier gerne Methylorange oder Bromthymolblau verwendet werden. Diese besitzen einen Umschlagbereich in den gleichen Breitengeraden.
Werden hingegen schwache Säuren titriert, muss der Umschlagsbereich entsprechend basischer liegen. Methylorange oder Bromthymolblau würden vor dem Erreichen des Äquivalenzpunktes umschlagen, weshalb in solchen Fällen stattdessen Phenolphtalein verwendet wird.
Potentiometrie
Bei der Potentiometrie wird der Äquivalenzpunkt hingegen durch eine Spannungsveränderung bestimmt. Dafür befinden sich eine Messelektrode (Elektrode 1. Art) und eine Bezugselektrode (Elektrode 2. Art) in der Probelösung, die über eine Messschaltung miteinander verbunden sind. Während die Messelektrode konzentrationsabhängig ist, also von der Probelösung abhängt, ist die Bezugselektrode konzentrationsunabhängig.
Durch die Titration kommt es zu einer Konzentrationsveränderung in der Lösung, sodass zwischen den Elektroden ein elektrisches Differenzpotential entsteht. Bei der Neutralisation kann schließlich der Endpunkt gemessen werden, bei dem sich die Spannung schlagartig ändert. Als großer Vorteil der Potentiometrie kann genannt werden, dass das Messergebnis wesentlich genauer als bei der Verwendung eines Indikators ist.
Konduktometrie
Als dritte Endpunktbestimmung des Äquivalenzpunktes kommt die Konduktometrie infrage. Dabei wird während der Titrations-Durchführung die Leitfähigkeit der Probelösung kontinuierlich gemessen. Dies funktioniert mithilfe einer Anode und einer Kathode sowie Wechselstrom in der Probelösung.
Je mehr Ladungsträger vorhanden sind, desto höher ist folglich die Leitfähigkeit. Neutralisieren sich die Maßlösung und die Probelösung miteinander, entsteht ungeladenes Wasser. Dieses kann nicht mehr als Ladungsträger fungieren, sodass die Leitfähigkeit sinkt. Beim Erreichen des Endpunktes nimmt sie wieder stark zu, da mehr neue Ionen hinzukommen, die nicht mehr durch die vorher vorhandene Probelösung neutralisiert werden können.
Titrationsaufbau als Grundlage für korrekte Messungen
Die richtige Titration erfordert einen tadellosen Aufbau – erst dann ist es möglich, die Konzentration einer Stoffmenge exakt zu bestimmen. Dafür kommen sowohl verschiedene Reaktionstypen als auch diverse Endpunktbestimmungen infrage. Wichtig ist auf jeden Fall, dass die Methodik auf den jeweiligen Stoff angepasst wird.
FAQ
Für eine erfolgreiche Titration sind neben einer Maßlösung und der Probelösung auch ein Messgerät oder ein Indikator notwendig. Dann werden die Lösungen durch Tröpfeln so lange vermischt, bis der Äquivalenzpunkt erreicht wurde.
Die Entfärbung wird durch einen Indikator erzeugt und stellt einen Farbumschlag dar. Dieser gibt an, dass der Endpunkt erreicht ist, sodass die Titrations-Durchführung beendet werden kann. Aus der verbrauchten Stoffmenge lässt sich dann die Konzentration ganz einfach berechnen.
Die Titrationskurve zeigt bei einer Säure-Base-Titration sowohl die verbrauchte Stoffmenge und den dazugehörigen pH-Wert als auch den Äquivalenzpunkt an. Außerdem lassen sich der anfängliche pH-Wert sowie der etwaige Pufferbereich und pKS-Wert ablesen.
Für eine Titration sollte immer ein solcher Indikator gewählt werden, dessen Farbumschlag im Bereich des Endpunktes liegt. Für starke Säuren und starke Basen kommen beispielsweise Methylorange und Bromthymolblau infrage. Bei schwachen Säuren eignet sich hingegen Phenolphtalein deutlich besser.
Sie haben Fragen zum Thema oder möchten einen Themenvorschlag äußern? Kontaktieren Sie uns gern telefonisch unter +49 30 2096579 00 oder schicken Sie uns eine Mail an info@medsolut.com.




